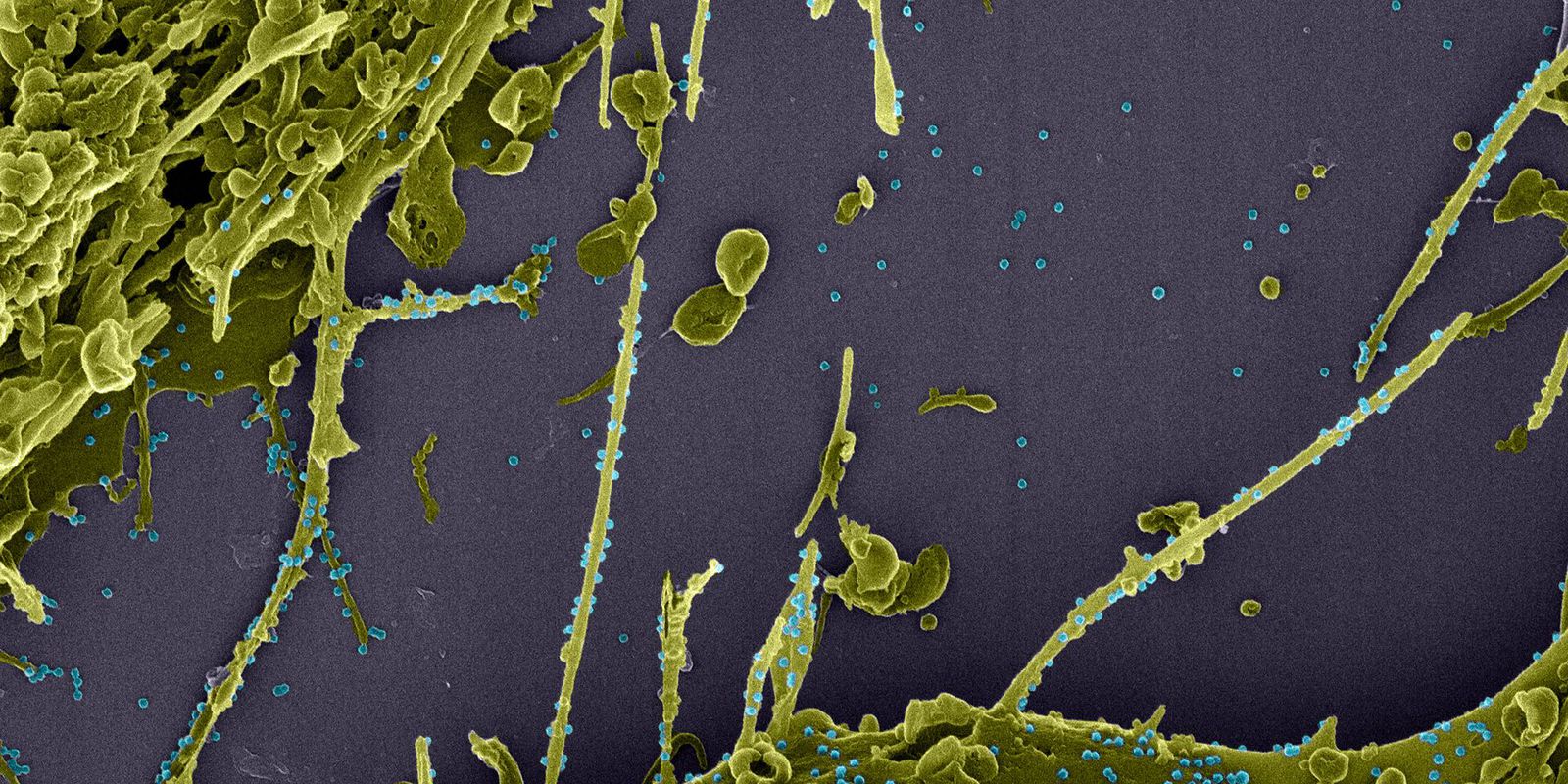
Estudos científicos publicados em duas áreas da revista médica Lancet indicam que as pessoas infectadas com a variante do SARS-CoV-2 identificada no Reino Unido não contraem formas mais graves da covid-19.

Os estudos foram feitos por observação, analisando a situação de pessoas infectadas com a variante designada como B.1.1.7, em um hospital de Londres, no Reino Unido, e por meio do que cerca de 37 mil pessoas infectadas declararam num trabalho britânico de acompanhamento de sintomas.
Em artigo publicado no boletim The Lancet Infectious Diseases, foram analisados 341 doentes admitidos no hospital do University College e no hospital da Universidade de North Middlessex em novembro e dezembro passado. A conclusão foi que os infectados com a variante não ficaram doentes com maior gravidade, mas a carga viral foi superior.
“Não se detectou prova de uma associação entre a variante e doença mais grave, com 36% dos doentes com a B.1.1.7. a ficarem gravemente doentes e a morrerem, quando comparado com os 38% dos que tinham uma variante diferente”, concluíram os pesquisadores, que reconhecem a necessidade de investigação mais aprofundada.
Em outro estudo, divulgado na publicação The Lancet Public Health, analisaram-se dados submetidos à aplicação Covid Symptom Study entre setembro e dezembro de 2020, que foram cruzados com as análises genéticas regionais conduzidas pelas autoridades de saúde britânicas destinadas a detectar a presença de variantes.
“A análise revelou que não há associações estatisticamente significativas entre a proporção da B.1.1.7. entre regiões e os tipos de sintomas que as pessoas tiveram”, concluíram os pesquisadores.
Além disso, a proporção de pessoas que tiveram casos prolongados de covid-19, com sintomas persistentes, não foi alterada pela presença da variante.
No entanto, os autores concluíram que o índice de transmissibilidade (Rt) é 1,35 vez superior na variante B.1.1.7.
A investigadora Britta Jewel, do Imperial College, comentou que o estudo contribui para o consenso de que a B.1.1.7. aumenta a transmissibilidade, o que levou, em grande parte, ao aumento exponencial de casos no Reino Unido e em outros países europeus.
*Com informações da RTP – Rádio e Televisão de Portugal







Deixe um comentário